Ricercatori dell’Università Cattolica del Sacro Cuore e del Policlinico A. Gemelli di Roma hanno messo a punto una tecnica per tracciare il transito dei rifiuti dentro le cellule, ovvero seguire i viaggi intracellulari di vescicole contenenti materiali di scarto che devono finire nei “centri di riciclaggio cellulari”, i lisosomi.
Questo sistema di smaltimento e riciclaggio dei rifiuti cellulari - chiamato autofagia - è un processo coinvolto in molte malattie, per esempio patologie neurodegenerative, come le malattie di Parkinson e Alzheimer, la Corea di Huntington e le distrofie muscolari, nonché in numerose forme di tumore. Patologie molto diverse, ma accomunate dal fatto che organelli cellulari e proteine danneggiati non vengono smaltite dalle cellule e quindi si accumulano progressivamente innescando un processo di infiammazione e danno tissutale.
 Il sistema di tracciatura del transito dei rifiuti cellulari - che potrebbe aiutare la comprensione, la diagnosi e la cura delle suddette malattie - è stato messo a punto dal dottor Giuseppe Maulucci (nella foto) e dal professor Marco De Spirito dell’Istituto di Fisica della sede di Roma dell’Università Cattolica in collaborazione con il dottor Giovambattista Pani dell’Istituto di Patologia Generale dello stesso Ateneo.
Il sistema di tracciatura del transito dei rifiuti cellulari - che potrebbe aiutare la comprensione, la diagnosi e la cura delle suddette malattie - è stato messo a punto dal dottor Giuseppe Maulucci (nella foto) e dal professor Marco De Spirito dell’Istituto di Fisica della sede di Roma dell’Università Cattolica in collaborazione con il dottor Giovambattista Pani dell’Istituto di Patologia Generale dello stesso Ateneo.
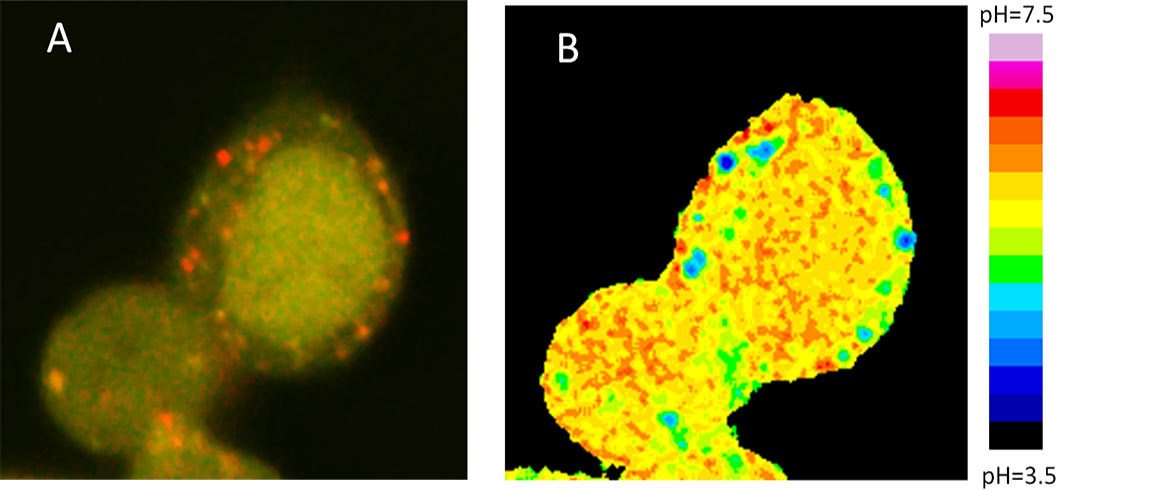
Si tratta, è spiegato in una recentissima pubblicazione sulla rivista Autophagy, di un sistema biotecnologico basato sull’uso di una proteina fluorescente che cambia colore a seconda dell’acidità dell’ambiente. Poiché i lisosomi, dove avviene la degradazione dei rifiuti cellulari, sono molto acidi, quando le vescicole arrivano in quella sede diventano rosse e si possono vedere con un microscopio a fluorescenza.
I ricercatori della facoltà di Medicina e chirurgia dell’Università Cattolica hanno per la prima volta messo a punto un sistema per seguire il processo in tempo reale, utilizzando le mappe cromatiche prodotte dal transito delle vescicole.
La proteina creata è in realtà una “chimera”, fatta da tre proteine fuse insieme, una delle quali (GFP) si accende in base all’acidità “ambientale”. Quando l’ambiente è molto acido - nel lisosoma - si accende la luce rossa, quando invece la vescicola è lontana dal “cestino”, si colora di giallo (verde+rosso), perché l’ambiente circostante è neutro.
Da queste informazioni ottenute dalla gradazione cromatica è possibile capire quanto è efficiente il processo di riciclaggio: se ho solo segnali gialli l'autofagia è stata bloccata; se ci sono troppi rossi l'autofagia è invece troppo accelerata.
«Grazie a questa biotecnologia il flusso autofagico può essere rapidamente e quantitativamente determinato» spiega il dottor Giuseppe Maulucci. «La nostra prospettiva futura è quella di associare questa metodica a strategie volte a modulare l’autofagia, al fine di monitorare con alta precisione l'effetto su cellule e tessuti: Questo approccio condurrà allo sviluppo di terapie nelle numerose patologie in cui è coinvolto un difetto funzionale del processo autofagico», conclude il ricercatore dell’Università Cattolica.